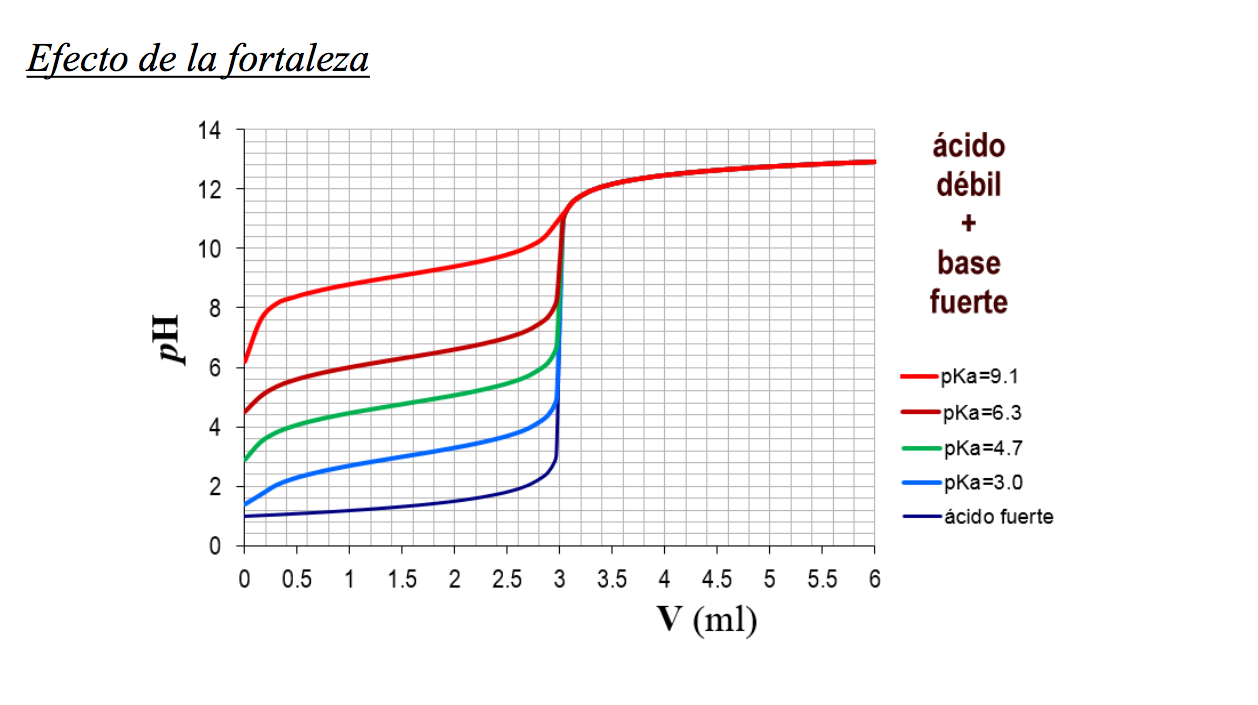
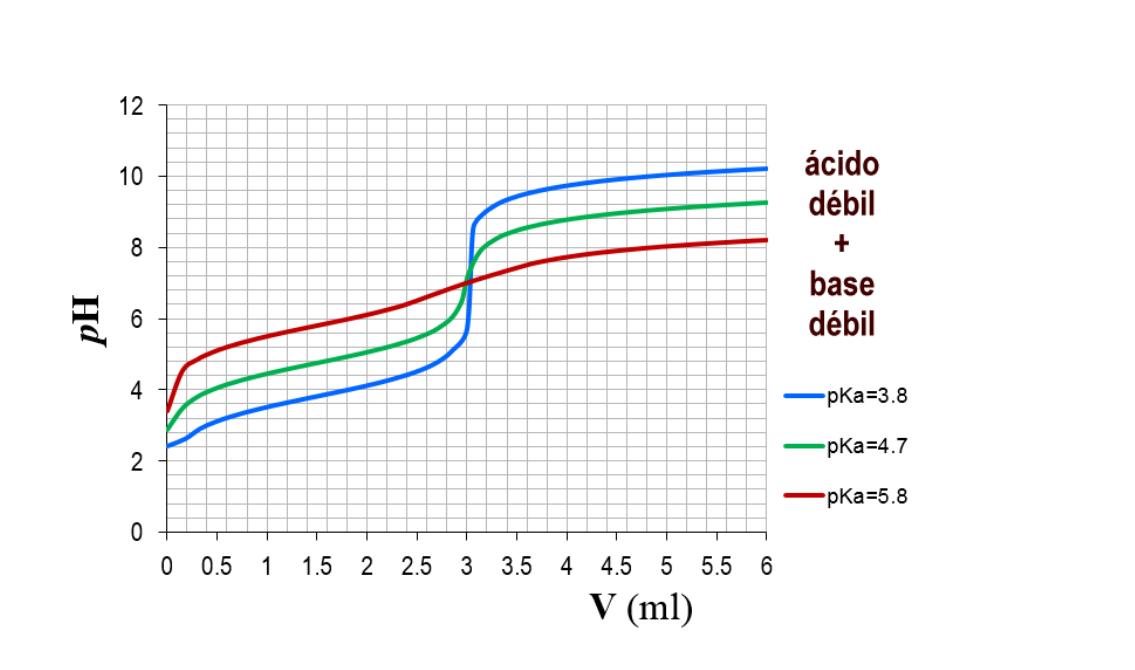
Figura 14.20 Curvas de titulación de ácidos fuertes y débiles que ilustran la elección adecuada del indicador ácido-base. Cualquiera de los tres indicadores mostrará un cambio de color razonablemente agudo en el punto de equivalencia de la titulación del ácido fuerte, pero solo la fenolftaleína es adecuada para su uso en la titulación.. Titulación de bases débiles y ácidos fuertes. En una titulación de base débil - ácido fuerte, el analito es la base débil y el valorante es el ácido fuerte. Una base débil se disociará sólo parcialmente mientras que un ácido fuerte se disociará completamente. Un ejemplo de base débil es el amoníaco, NH 3.
Práctica No.13. Neutralización de un ácido fuerte con una base fuerte
Acido base

Titulación de una base débil con un ácido fuerte YouTube

Titulación ácido fuerte base fuerte YouTube

VALORACION DE UN ACIDO DEBIL CON UNA BASE FUERTE

(PDF) TITULACION, ACIDO FUERTE BASE FUERTE DOKUMEN.TIPS

TITULACION, ACIDO FUERTE BASE FUERTE
Valoraciones acido fuerte base fuerte
Mezcla acido fuertebase debil YouTube

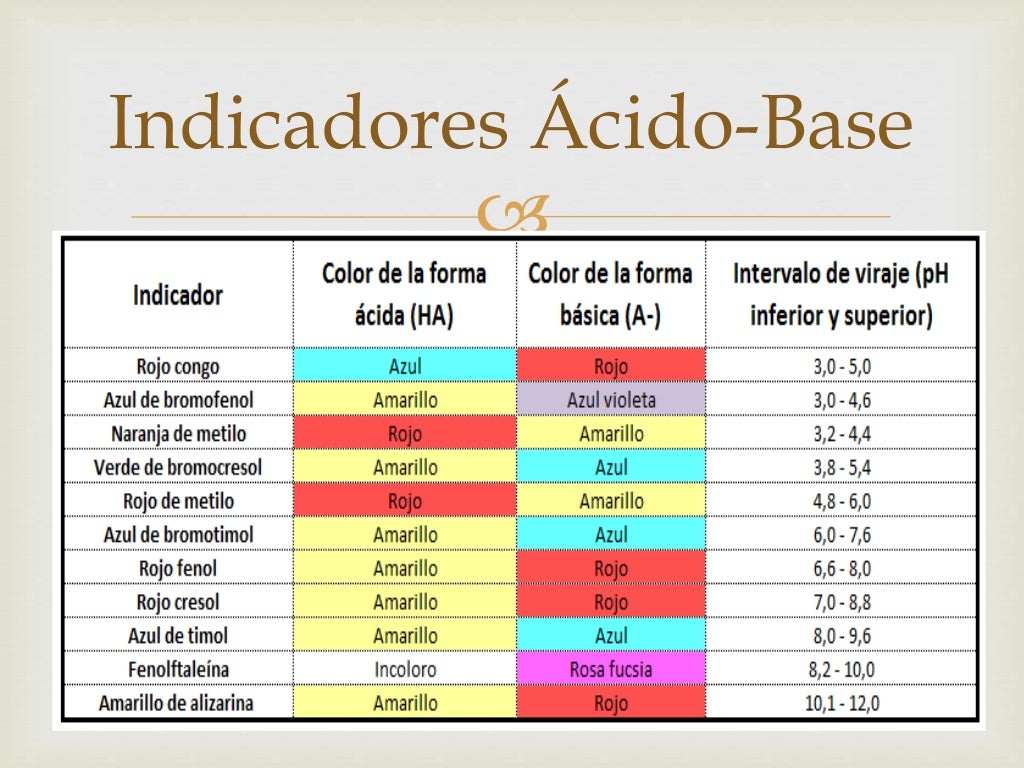
¿Qué es un indicador ácido base? Funcionamiento y ejemplos YuBrain
Titulación ácido fuerte base fuerte YouTube

Reporte titulación del ácido fuerte y base fuerte Química Valoración

Titulación ácido fuerte base fuerte YouTube
Documento sin título

Reacciones Entre Un Acido Fuerte y Una Base

Curvas de titulación e indicadores ácidobase YouTube

Mezcla de un ácido fuerte con una base fuerte YouTube
Documento sin título
Ejemplo De Curva De Valoracion De ácido Fuerte Con Base Fuerte

Valoracion Acido Base Ph Ramas de la termodinámica Prueba
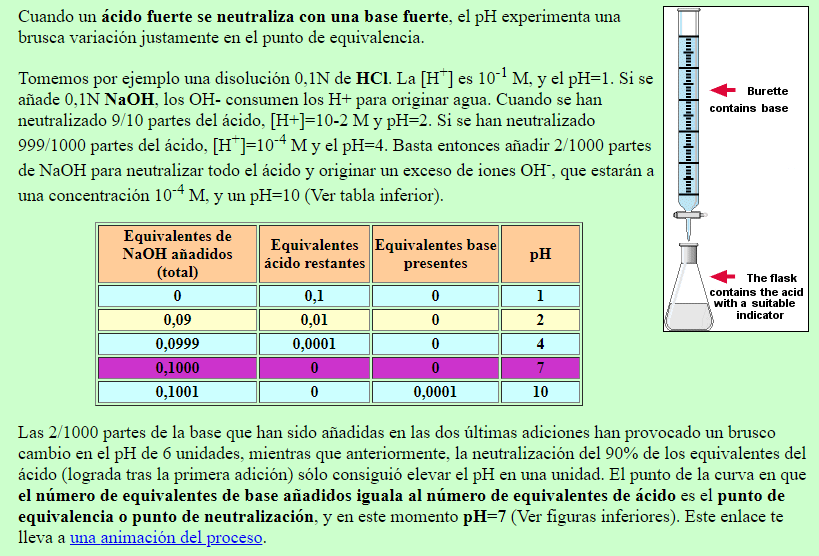
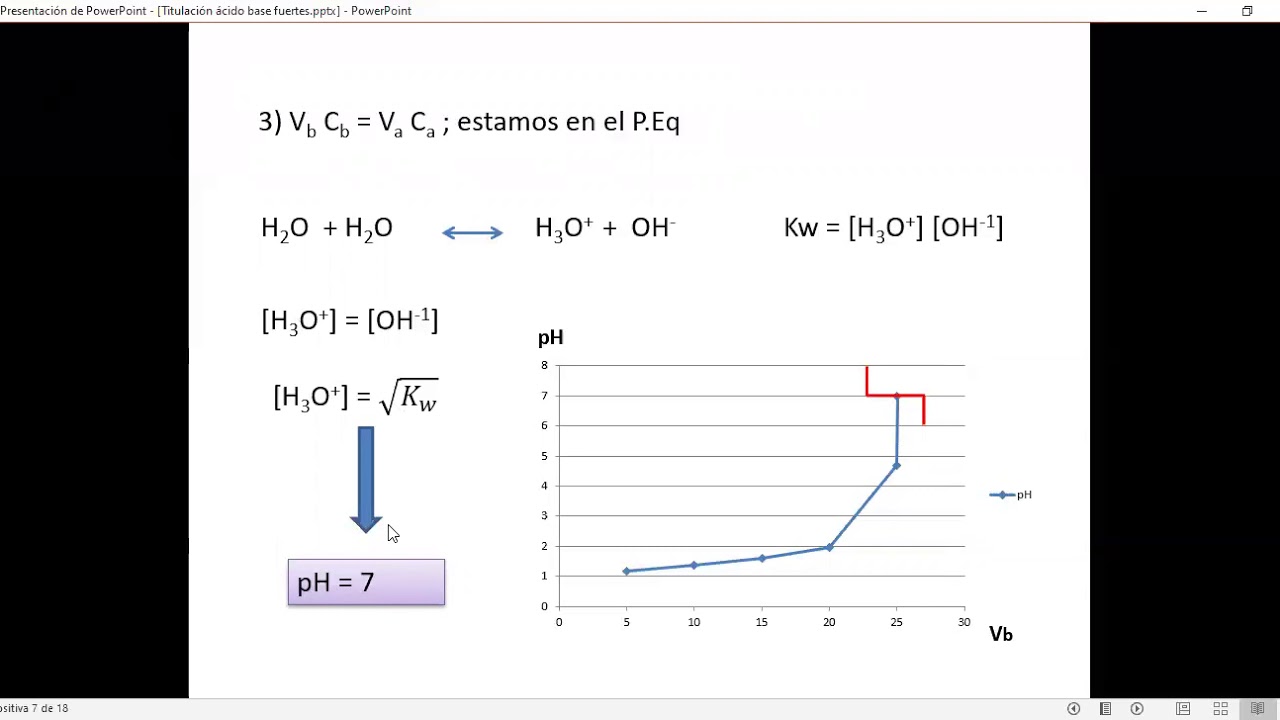
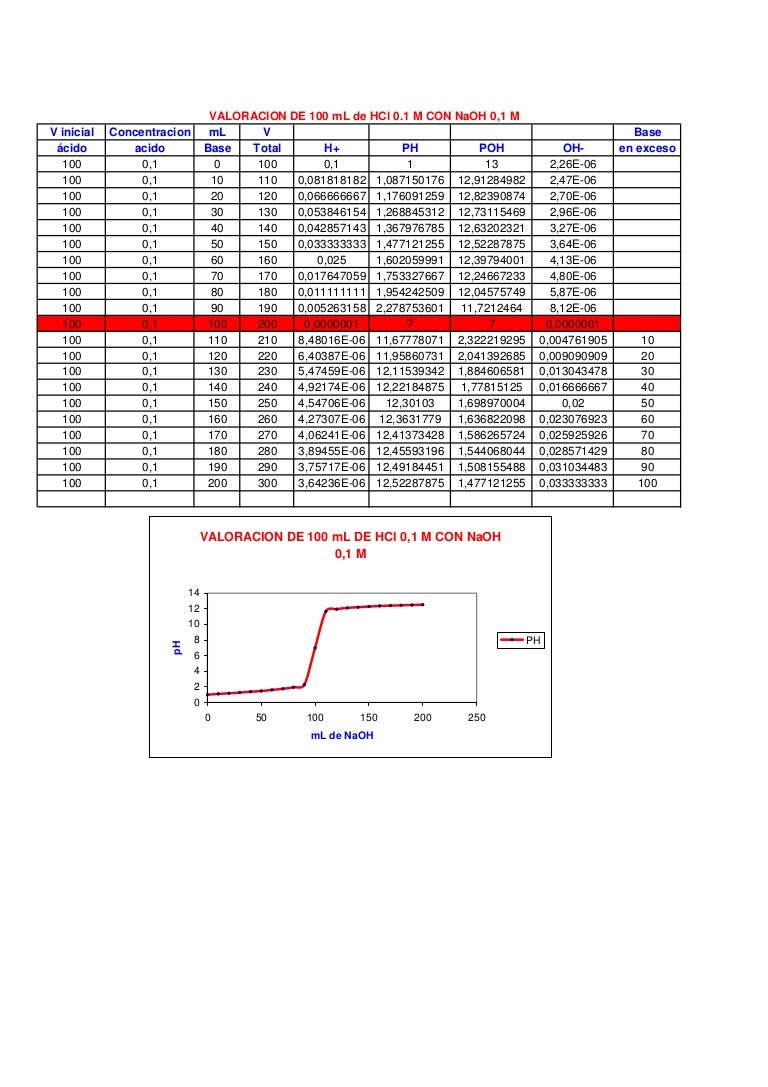
Tabla [Math Processing Error] 14.7. 1: Valores de pH en las valoraciones de un ácido fuerte con una base fuerte y de un ácido débil con una base fuerte. Volumen de 0.100 M NaOH añadido (mL) Moles de NaOH añadidos. Valores de pH de 0.100 M HCl1. Valores de pH de 0.100 M [Math Processing Error] C H 3 C O 2 H 2.. La siguiente figura muestra una variedad de indicadores ácido-base que pueden ser utilizados en experimentos de titulación. Figura 21.20.1 21.20. 1: Indicadores de pH. (CC POR-NC; CK-12) Dependiendo del pH en el punto de equivalencia, se debe elegir el indicador apropiado. Por ejemplo, el azul de bromfenol tiene un color amarillo por debajo.